近日,永利集团三亚南繁研究院王华锋教授团队博士后Qamar U Zaman为第一作者在Trends in Biotechnology[2022年影响因子IF=21.942, 中科院一区,Top期刊]上发表题为New possibilities for trait improvement via mobile CRISPR-RNA的文章,揭示CRISPR-RNA带来的生产革命,提供了超前的育种思路。王华锋教授和澳大利亚莫道克大学(Murdoch University)Rajeev K Varshney教授为共同通讯作者。本研究得到本项研究由海南省重点研发(ZDYF2022XDNY190)、三亚崖州湾科技城项目(SCKJ-JYRC-2022-83)和永利集团南繁与热带高效农业协同创新中心项目(XTCX2022NYB09)的资助。此外,我们还向所有参与这项研究的合作者和帮助者表示诚挚感谢!
CRISPR/Cas9基因技术以RNA的形式从转基因根运输到未修饰的嫁接接穗的远端部分,并被翻译成蛋白质,以在所需位点诱导可遗传的突变。这项技术有可能在难以繁殖和濒临灭绝的物种中产生无转基因和遗传稳定的植物。
应用移动CRISPR-RNA编辑植物基因组
基因组工程正进入植物性状改良的新时代。工程作物基因组的能力正在迅速发展,并已应用于主要作物以获得所需的性状。然而,尽管最新的技术进步,基因组编辑试剂传递系统仍然依赖于基因型和组织培养再生。TLS作为一个信号,针对植物CRISPR/Cas9转基因技术可以实现从根到枝的长距离移动,从而可以有效地编辑嫁接接穗。一种野生型拟南芥(拟南芥)将接穗嫁接到表达Cas9mRNA和用TLS标记的硝酸还原酶1(NIA1)标记的gRNAs的转基因拟南芥砧木上。移动转录物有效地产生缺失,并且由于编辑的硝酸还原酶编码基因,AtNIA1突变体表现出预期的表型,这表明两个转录物成功地移动到接穗中。拟南芥突变体表现出褪绿表型(叶片产生的叶绿素不足,从他们的叶色的野生型区分)。移动Cas9-TLS转录物翻译成野生型接穗中的功能蛋白,以获得有效的基因表达。
在另一项研究中,将甘蓝嫁接到转基因拟南芥根中含有Cas9/ GRNA-TLS系统移动记录移动到Brapa芽的远端部分,包括茎和花(图A)。Cas9-TLS转录物在受体组织中翻译成功能蛋白,并表现出有效的靶向缺失。最终,嫁接接穗的花朵产生了可遗传突变的无转基因种子。
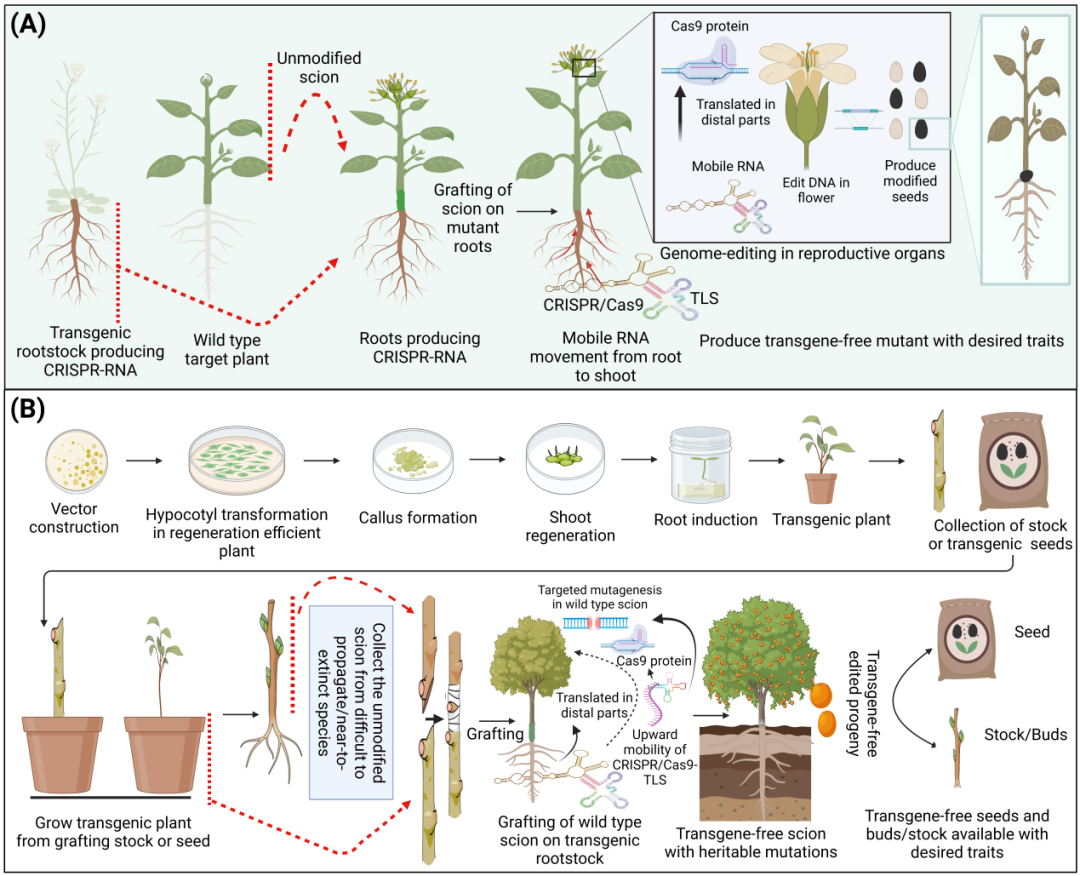
基于移动CRISPR的策略有与传统相比更有优势
这种基因组编辑方法绕过了组织培养转化的限制具有相当大的意义,可以被用来生产气候智能型作物,尤其是应用于在难以繁殖和无性繁殖的作物。也可用于诱导濒临灭绝的植物物种在气候变化下的胁迫耐受性。我们描述了基于移动CRISPR的基因组编辑的现状及其潜在的应用,在难以繁殖、克隆繁殖和接近灭绝的植物物种中,无需组织培养方法即可提供CRISPR试剂。
移动CRISPR-RNA系统在难繁殖和无性繁殖植物嫁接中的应用
CRISPR系统已广泛应用于植物。然而,它的使用对于许多植物物种来说仍然具有挑战性,因为CRISPR转化效率仍然依赖于基因型、组织培养和组织培养。
转移类RNA序列
TLS首先在芜菁黄花叶病毒(TYMV)的基因组中被鉴定。TLS的功能长期以来一直不清楚,其作用在不同类型的病毒中也各不相同。然而,它似乎是直接宿主核糖体内部转位到起始位点的过渡。在TYMV系统中加强翻译和控制核糖体/复制酶的运输。研究发现,在拟南芥中,2006个基因产生的可移动RNA能够在正常和营养缺乏的条件下在各种器官之间移动。独特的TLSs有助于mRNAs从转基因根到叶,从叶到野生型花或根的运动。此外,这些移动RNA可在特定组织中翻译成蛋白质。
CRISPR机制
近年来,天然CRISPR系统已被用于基因组工程。CRISPR是免疫系统的一部分,保护细菌和古生菌免受噬菌体和结合质粒。它首先在大肠杆菌中被观察到,主要依赖于小的CRISPR-RNAs(crRNAs)。CRISPR-Cas系统包括三个基本步骤:间隔序列获取,CRISPRRNA生物合成和RNA引导的识别和消除。[81crRNA和tracrRNA的嵌合体与Cas蛋白结合。其激活核酸酶结构域以在靶DNA中诱导突变,通常在原间隔区相邻基序(PAM)上游3个碱基对处。
CRISPR相关蛋白
不同的CRISPR相关蛋白被用于植物的基因组编辑,包括Cas9dCas9Cas12a/Cpf1Cas13a/C2c2 具有各种PAM区域的碱基编辑器和引物编辑器。这种多样性提供了一个机会,挑选一种新的蛋白质,可以产生有针对性的基因组编辑没有脱靶效应。不同的Cas蛋白显示不同的PAM区域,促进基因的阻遏、激活和干扰。植物中病毒的检测、对入侵噬菌体的免疫、RNA编辑和碱基编辑移动CFISPR系统可以方便在目标站点上进行精确的诱变,立即产生无dna突变体,从DNA编辑到RNA编辑,包括DNA碱基编辑、引物编辑和rna碱基编辑,正在以极大的特异性和效率革命性地改变基础研究。这些工具可以适应TLS系统,在不久的将来有利干难以繁殖和濒临灭绝的物种。
从崖州湾走向世界
本工作是在王华锋教授实验室内完成的,实施CRISPR-RNA技术。博士后Qamar U Zaman致力于开发一种“超级火龙果”基因型,该基因型能够耐受非生物胁迫,尤其是重金属、高温和干旱。由于气候变化导致植物更多地受到非生物胁迫,并可能因频繁的干旱、酷热和荒漠化影响生态系统而造成灾难。在热胁迫期间,气孔打开以通过蒸腾作用冷却叶片,但在干旱期间,气孔关闭以防止水分损失。然而,在干旱和热胁迫的组合过程中,不同植物的气孔保持关闭,这表明干旱驱动的气孔调节在胁迫组合过程中克服了热胁迫驱动的调节。调节火龙果对压力的反应的不同途径、和激素是如何相互作用的,以及在压力组合过程中这些相互作用是如何调节的,这些都是有待进一步研究的悬而未决的问题。因此,Qamar U Zaman博士主要在王教授的实验室中研究开发“超级火龙果”。
未来我们团队拟申报国家和海南项目,希望在项目的持续支持下,应用移动CRISPR在内的现代和传统育种方法,生产“超级火龙果”,服务乡村振兴,让自主知识产权的火龙果新品种从北纬18度的崖州湾走向东南亚一带一路沿线国家、走向非洲、走向全世界,为世界粮食安全做出新的更大贡献!
敬请各位领导、老师和朋友支持,谢谢大家!
论文的链接:https://doi.org/10.1016/j.tibtech.2023.05.001
https://www.sciencedirect.com/science/article/pii/S0167779923001488?dgcid=coauthor
 永利集团
永利集团
 南繁研究院
南繁研究院